RESUMEN
La difusión juega un rol decisivo en muchos procesos metalúrgicos y, por ende, su estudio reviste gran importancia. Se produce por la existencia de defectos, pudiendo determinarse así coeficientes de difusión en volumen, en bordes de grano (BG) ó de interfase (BI), en dislocaciones, en superficie, etc.
Tanto los BG como los BI muestran velocidades de migración varios órdenes de magnitud mayores que las correspondientes al volumen de las regiones adyacentes; a temperaturas en las que ésta puede considerarse prácticamente nula, una apreciable aunque localizada cantidad de material puede estar desplazándose a lo largo de los “caminos rápidos”. Esto implica que los fenómenos asociados a la difusión muestren en BG y BI una importante aceleración. Entre ellos, deformación plástica y corrosión a alta temperatura, sinterizado, transformaciones en estado sólido en general, etc.
Se presentan resultados de difusión de Co en BG de Zr-α puro, en el rango de temperaturas [430-633] K. Se utilizaron las cinéticas B y C de la clasificación de Harrison, siendo los correspondientes a la cinética C los primeros en este tipo de materiales. El Co resultó ser un difusor ultrarrápido en los “caminos rápidos”, al igual que en el volumen. La comparación entre las cinéticas B y C permitió obtener una evaluación directa del factor de segregación del Co en los BG.
Palabras clave: difusión, borde de grano, segregación, Zr, nuclear.
1. INTRODUCCIÓN
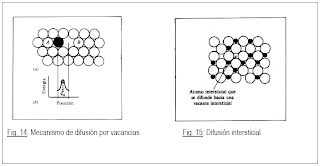
La difusión en estado sólido juega un rol decisivo en la mayoría de los procesos metalúrgicos, y por ende, la determinación de los valores de los coeficientes de difusión, parámetro que caracteriza dicho fenómeno, reviste gran importancia. En los materiales en general y en los metales en particular, la difusión se produce por la existencia de defectos: puntuales, lineales, bi y tridimensionales, existiendo formas experimentales que permiten identificar si la difusión se realiza a través de uno u otro tipo de defectos. Se determinan así los coeficientes de difusión en volumen, en bordes de grano, en dislocaciones, etc.
Un borde de grano (BG) se define como la región de transición entre dos cristales adyacentes en un material monofásico, los que están en contacto y solo difieren en la orientación cristalográfica. Cuando la zona de transición entre dos granos ocurre entre dos fases de una aleación, se denomina borde de interfase (BI). En él, las regiones adyacentes difieren tanto en orientación cristalográfica como en composición. Los BG y BI son zonas altamente desordenadas si se comparan con las regiones cristalográficas contiguas, por lo que conforman un medio mucho más “abierto” para el movimiento atómico que las regiones adyacentes. Esto redunda en velocidades de migración varios órdenes de magnitud mayores que las correspondientes al volumen de las regiones adyacentes por los que se denominan como “caminos rápidos” o “corto-circuitos” para la difusión. A temperaturas en las que la difusión en volumen puede considerarse prácticamente nula, una apreciable aunque localizada cantidad de material puede estar desplazándose a lo largo de los “caminos rápidos”, implicando que todos los fenómenos a ella asociados presenten una importante aceleración. Entre ellos, podemos mencionar: deformación plástica y corrosión a alta temperatura, sinterizado, transformaciones en estado sólido, etc.
En el área nuclear, el Zr puro y algunas de sus aleaciones, como Zircaloys y Zr-Nb, son muy empleados debido a sus buenas propiedades mecánicas y su excelente resistencia a la corrosión. Se presentan por lo general en forma de agregados policristalinos, monofásicos como en el Zircaloy-2 y 4 y bifásico como en el Zr-2.5%Nb, por lo que tanto BG como BI son defectos de gran importancia cuando se analiza y predice el comportamiento de estos materiales. Por ello en el grupo Difusión se han efectuado numerosos estudios de difusión en BG y BI {[1] y referencias ahí mencionadas}.
En este trabajo se presentan resultados de la difusión de Co en BG de Zr-α puro, en el rango de temperaturas [430-633]K, generando además, un avance en la determinación de la segregación del difundente respecto a lo publicado en [1].
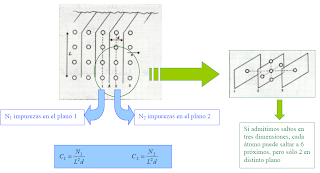
La difusión por BG y BI en materiales policristalinos es un proceso complejo que involucra una serie de fenómenos elementales: difusión por volumen proveniente de la superficie, difusión a lo largo del BG o BI, difusión por volumen proveniente del BG o BI.
Dependiendo de la importancia relativa de cada uno de estos procesos se pueden apreciar diferentes cinéticas. Esta importancia relativa varía con el tratamiento térmico de las experiencias de difusión y con el tamaño de grano. Cada cinética tiene lugar en un determinado dominio de temperaturas-tiempos. El conocimiento de todos los posibles regímenes es de extrema importancia tanto para el diseño de los experimentos como para interpretar sus resultados. La primera clasificación de cinéticas y la más utilizada es la deHarrison [2]. Considera, en un policristal convencional, tres regímenes llamados A, B y C.
En este trabajo se utilizaron las cinéticas B y C siendo los valores correspondientes a la cinética C, los primeros en este tipo de material.
2. PROCEDIMIENTO EXPERIMENTAL
Se cortó el material en probetas de aproximadamente 0.75 cm2 de superficie. Se desbastaron mecánicamente a fin de obtener muestras de caras paralelas y se pulieron mecánica y químicamente; algunas fueron destinadas a la observación metalográfica a fin de constatar la correcta relación de la morfología deseada con la real, para la adecuada aplicación de las cinéticas.
El radiotrazador 60Co fue obtenido experimentalmente en los Laboratorios del Centro Atómico Constituyentes. Se irradió Co en esponja, se hicieron los cálculos del tiempo de irradiación para la obtención de la actividad necesaria para la experiencia de difusión. Se contó con la colaboración del personal del RA1 de la CNEA para la irradiación y del personal de Seguridad Radiológica para el transporte y estiba del material. Se estudió la forma más conveniente de disolución del Co, ensayando en primera instancia dos reactivos diferentes: ácido nítrico y clorhídrico concentrados, utilizando Co no irradiado. De acuerdo a los resultados obtenidos se decidió continuar las experiencias utilizando sólo ácido nítrico ya que genera menor cantidad de solución activa y la disolución se logra en menor tiempo. Además, según datos bibliográficos, la utilización del ácido nítrico en preferencia al ácido clorhídrico, minimiza el daño por corrosión localizada de las probetas, lo que, de suceder, perturbaría las experiencias de difusión. Se logró así la disolución del 60Co, para su posterior utilización.
Se realizó el depósito del radiotrazador en las caras especulares de las probetas preparadas, por deposición de unas gotas del 60Co diluído. Se envolvió cada probeta en tantalio laminado y se sellaron en tubos de cuarzo transparente a los que se les efectuó vacío y se les introdujo Ar de alta pureza de forma que a la temperatura de cada recocido existiera una ligera sobrepresión con respecto a la presión atmosférica. Los tratamientos térmicos fueron realizados en hornos eléctricos de precisión con controladores P-I-D, controlándose la temperatura con termocuplas de Cromel-Alumel calibradas. En todos los casos el tratamiento térmico se interrumpió con un templado brusco sin rotura del cuarzo.
Posteriormente, y antes del seccionamiento, se tornearon las probetas radialmente de forma de asegurar un frente de difusión plano proveniente desde la cara depositada. El seccionamiento se efectuó en una máquina seccionadora de precisión, determinándose la penetración alcanzada por medio de sucesivas pesadas en una balanza electrónica de precisión de 10-5gr. Se establecieron así las diferencias de pesadas (anterior y posterior a cada una de las abrasiones) a partir de las cuales, conociendo la densidad del Zirconio y la superficie de las muestras, se pudo determinar la penetración del difundente.
La concentración, proporcional a la actividad del difundente, fue determinada por medio de un detector de INa(Tl) de pozo y un sistema adquisidor/analizador multicanal.
3. RESULTADOS Y DISCUSIÓN
En el caso de nuestro trabajo, mostraremos las expresiones que permiten calcular los coeficientes de difusión en BG para las cinéticas B y C.
Cinética tipo B
Los procesos elementales de mayor importancia en esta cinética son dos: la difusión por BG y la difusión por volumen proveniente del BG. La distancia de difusión es mayor que el ancho del BG y mucho menor que el tamaño de grano. La penetración del trazador es mucho más profunda por los BG que por difusión en volumen proveniente directamente de la superficie y el flujo de trazador proveniente de un BG no se solapa con el flujo proveniente de otro BG, por lo que se asimila al modelo de borde de grano aislado de Fisher [3]. Para procesar el perfil se aplican las siguientes ecuaciones según sean las condiciones:
Fuente constante δ s Db = 1.322 (D/t)1/2 (-∂c/ ∂y6/ 5 )-5/ 3 (1)
Fuente instantánea δ s Db = 1.308 (D/t)1/2 (-∂c/ ∂y6/ 5 )-5/ 3 (2)
Donde δ: ancho del BG y s: factor de segregación, siendo Pbg = δ s Db el parámetro medible experimentalmente, llamado coeficiente de difusión aparente. La cinética B es la más usada ya que permite tiempos razonables de recocidos y un rango de temperaturas y distancias de difusión convenientes.
Cinética tipo C
En esta cinética el proceso elemental de mayor importancia es la difusión por BG.
Se considera que las distancias típicas de difusión por volumen son lo suficientemente pequeñas como para suponer que no hay filtrado lateral hacia el interior del grano y todo el material migra en una única estructura: la del borde de grano. El perfil de concentración en la cinética de tipo C puede ser, en consonancia con la teoría de difusión en volumen, una función gaussiana (fuente instantánea) o una función error (fuente constante), trabajando directamente con el coeficiente de difusión en BG (Dbg). En nuestro trabajo, la expresión que permite conocer el coeficiente de difusión en borde de grano corresponde a la conocida solución gaussiana:
C(x, t) = Co exp (-y2/4Dbgt), (4)
Donde Co representa la concentración de difundente en el plano inicial de difusión en el tiempo t.
Valores experimentales medidos. Discusión de los resultados
Se efectuaron siete tratamientos térmicos, correspondiendo tres de ellos a la cinética tipo B y los cuatro restantes a la cinética C. Perfiles de penetración típicos pueden apreciarse en las Figuras 1 y 2.

En el caso de la cinética B, el valor accesible experimentalmente es Pbg, cuyos valores se encuentran en la Tabla I. Para el cálculo de los respectivos valores se consideraron coeficientes de difusión en volumen interpolados a partir de los datos de Kidson [4].

Para el caso de la cinética C, se puede obtener directamente el coeficiente de difusión en borde de grano, Dbg, por aplicación de la solución gaussiana, en forma análoga a la difusión en volumen. La importancia de la utilización de este tipo de cinética se basa en que no necesitamos conocer los valores del ancho de BG ni el factor de segregación. Los valores medidos en este trabajo se encuentran en la Tabla II.

4. CONCLUSIONES
En este trabajo se midió, por primera vez, la difusividad del Co en los bordes de grano de Zr-α, en el régimen de cinética C. Se obtuvieron los coeficientes de difusión en borde de grano, se compararon con los de volumen de Co [4] a las mismas temperaturas, mostrando una relación alrededor de 106, en acuerdo con lo que predice la teoría de difusión por caminos rápidos. El gráfico de Arrhenius resulta recto, indicando un único mecanismo de difusión operante.
Las determinaciones de Pbg bajo la cinética B, muestran muy buena coincidencia con los valores medidos en [5], lo que resulta importante pues el Zr y las aleaciones de base Zr son fuertemente dependientes, en su aspecto difusivo, del tenor de impurezas.
Esto y la combinación de ambas cinéticas permite calcular los coeficientes de segregación cuyos valores varían fuertemente, aumentando desde un valor cercano a 50 hasta 15000 en un rango de temperaturas de aproximadamente 50 K.







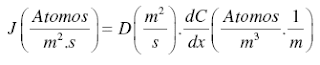





 Donde
Donde
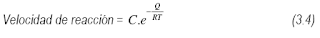

 En ausencia de difusion, un soluto introducido en un fluido en movimiento sera arrastrado por el flujo, pudiendo caracterizarse este movimiento por la ecuacion de ondas unidireccional —problema hiperbolico—:
En ausencia de difusion, un soluto introducido en un fluido en movimiento sera arrastrado por el flujo, pudiendo caracterizarse este movimiento por la ecuacion de ondas unidireccional —problema hiperbolico—: